Ischämischer Schlaganfall beim Menschen
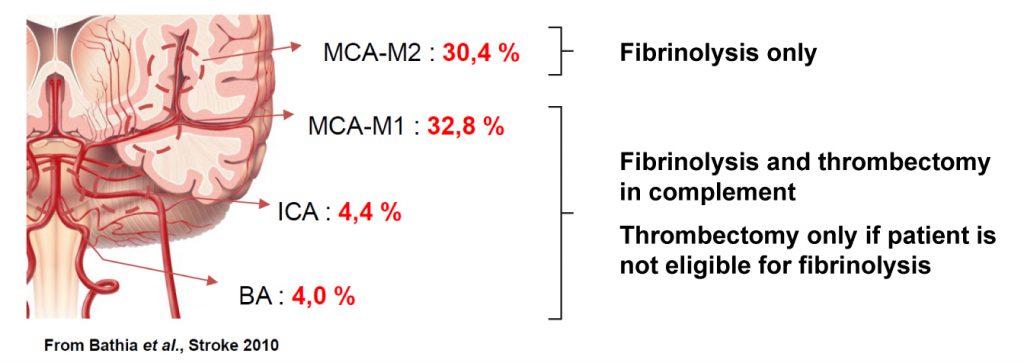
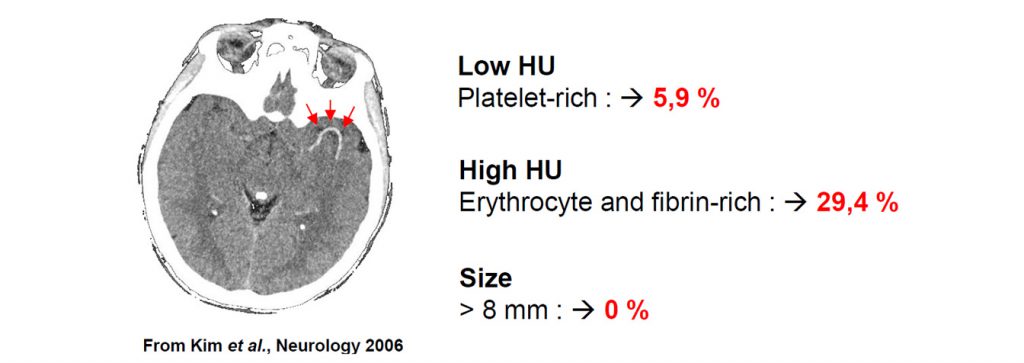
Die Wirksamkeit der Therapie ist abhängig von der Lokalisierung des Thrombus und dessen Zusammensetzung.
Die Wirksamkeit der Therapie ist abhängig von der Lokalisierung des Thrombus und dessen Zusammensetzung.
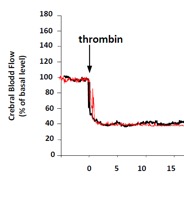
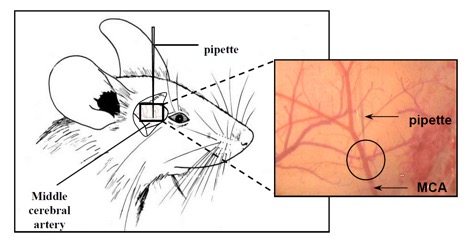
Gemeinsame Herangehensweise: Alle unsere experimentellen Modelle eines lakunären ischämischen Schlaganfalls werden mit denselben chirurgischen Protokollen an Mäusen durchgeführt. Die zerebrale Ischämie wird über einen externen Zugang (Kraniotomie) über die Arteria cerebri media (ACM) an der Aufzweigung zwischen den Segmenten M2 und M3 induziert. Anschließend wird je nach gewähltem Modell ein spezifisches Thromboseprotokoll durchgeführt. Die Gerinnselbildung wird mithilfe der Laser-Doppler-Technik kontrolliert. Unabhängig vom Modell sind die induzierten Läsionen auf den Cortex cerebri beschränkt; die Mortalität ist sehr gering (< 1 %).
Für Ihre wissenschaftlichen Fragestellungen stehen vier Modelle einer distalen Ischämie zur Verfügung:
Für jedes Modell gilt Folgendes:
-> Publikationen und umfangreiche Daten verfügbar
-> Für mechanistische Studien können gentechnisch veränderte Mäuse verwendet werden
-> Vielzahl von Protokollen für die Verabreichung der Prüfsubstanz verfügbar, einschließlich langfristiger Behandlungen wacher Mäuse
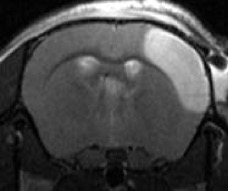
Thrombose durch fibrinreichen Thrombus
Thrombose durch Plättchenthrombus
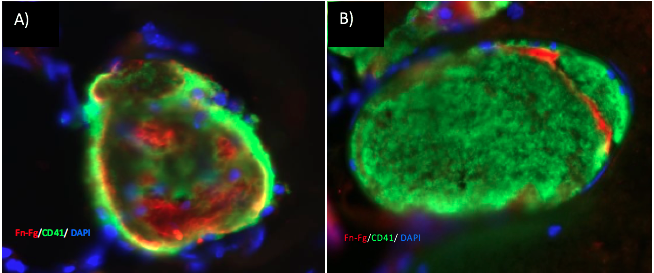
Abb. 1: Histologie von Gerinnseln, die entweder durch a) Thrombin oder b) FeCl3 induziert wurden Thrombin-induzierte Thromben enthalten mehr Fibrin und weniger Thrombozyten als mit FeCl3 gebildete Thromben. Abgebildet sind Fibrin (rot), Thrombozyten (grün) und DAPI (blau).
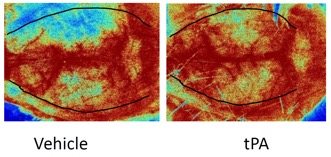
Abb. 2: Laser-Speckle-Kontrastanalyse der Reperfusion des Cortex cerebri nach t-PA-Fibrinolyse des fibrinreichen Thrombusmodells in Mäusen. Die gestrichelte Linie zeigt den ischämischen Bereich.
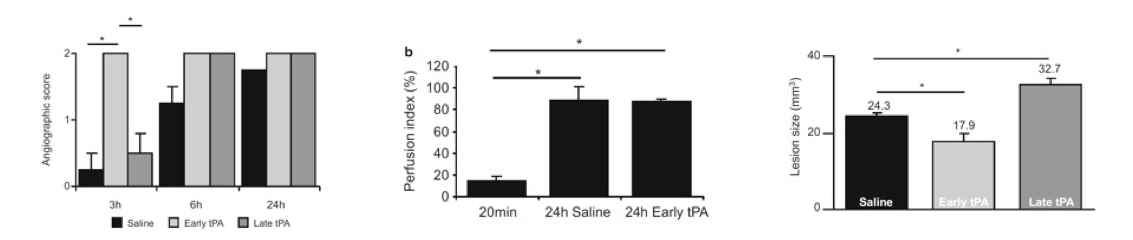
Abb. 3: Fibrinreiches Thrombusmodell in Mäusen: Wirkung einer frühen (20 min) oder späten (4 h) t-PA-Fibrinolyse. a) angiographischer Score 3 h, 6 h bzw. 24 h nach Schlaganfall (TOF-MRA). b) Perfusionsindex 20 min bzw. 24 Stunden nach Schlaganfall (PWI-MRT). c) Läsionsgröße 24 h nach Schlaganfall (T2-gewichtete MRT). * p < 0,05. Daten ausgedrückt als Mittelwert ± SEM.
Adaptiert von Orset et al., Neuromethods, 2016, 120:59-68.
Permanente Ischämie
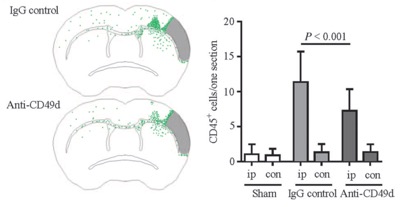
Abb. 4: Beispielhaftes Ergebnis aus dem permanenten Ischämiemodell in Mäusen, um die Wirkung von anti-CD49d-Antikörpern auf die Leukozyten-Infiltrierung zu beurteilen. Die Ergebnisse wurden 7 Tage nach dem Schlaganfall erfasst: a) überlagerte Verteilung von CD45+-Leukozyten aus der Kernregion des Infarkts; b) Anzahl der CD45+-Leukozyten in der ipsilateralen (ip) und kontralateralen (con) Hemisphäre. Daten ausgedrückt als Mittelwert ± SEM. IgG: Kontroll-Antikörper.
Adaptiert von Llovera et al., Science Translationnal Medicine, 2015, 7:299ra121.
Transitorische ischämische Attacke (TIA)
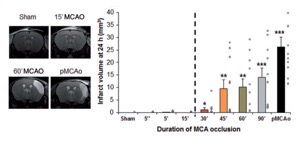
Abb. 5: Infarziertes Hirnvolumen 5 Sekunden bis 90 Minuten nach ACM-Okklusion. Eine 15-minütige Okklusion ahmt eine TIA nach. n = 10 pro Gruppe. *p < 0,05, **p < 0,01 und ***p < 0,001 im Vergleich zur Scheinbehandlung. Daten ausgedrückt als Mittelwert ± SEM. pMCAO: permanente Okklusion.
Adaptiert von Quesnault et al., Brain, 2017, 140:146-157.
Thromboembolischer Schlaganfall: Version mit einem Thrombus (Ratte)
Thromboembolischer Schlaganfall: Version mit mehreren Thromben (Ratte)
Thromboembolischer Schlaganfall: Version mit mehreren Thromben (Ratte)
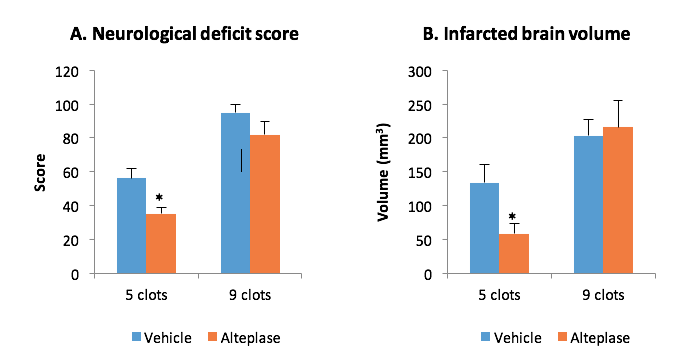
Abb. 1: Wirkung von Alteplase (i.v. 2 h nach Schlaganfall) auf neurologische Ausfall-Symptomatik (a) und Läsionsvolumen (b) 24 h nach thromboembolischem, mit fünf oder neun Thromben induziertem Schlaganfall bei Ratten. Bei 9 Thromben wird eine Resistenz gegenüber Alteplase erreicht. *p < 0,05 im Vergleich zu Vehikel (Placebo). Daten ausgedrückt als Mittelwert ± SEM. Interne Validierungsdaten.
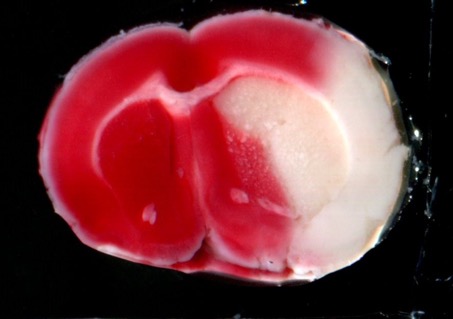
Abb. 2: Repräsentative, mit TTC gefärbte Schnitte aus distalen Schlaganfallmodellen. Infarziertes Hirngewebe färbt sich nicht rot.
Klinische Prüfungen am Menschen sind dadurch charakterisiert, dass der Schweregrad der von einem Schlaganfall verursachten Beeinträchtigungen stark schwankt. Beurteilt wird der Schweregrad mit Skalen wie NIHSS oder der Rankin-Skala. So ergab die NINDS-Studie (NINDS, N Engl J Med, 1995, 333:1581-1588), dass 20 % der Patienten drei Monate nach dem Schlaganfall keine oder nur leichte Beeinträchtigungen und 27 % der Patienten mittelschwere bis schwere Symptome hatten. 21 % der Patienten waren zu diesem Zeitpunkt verstorben. In dieser Studie beeinflusste Alteplase die Anteile in den verschiedenen Kategorien leicht (Abb. 1).
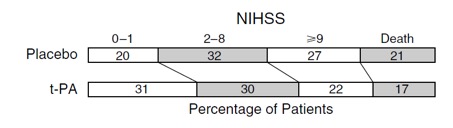
Abb. 1: Wirkung von Alteplase (rt-PA) auf das Outcome 3 Monate nach Schlaganfall.
Adaptiert von NINDS, N Engl J Med, 1995, 333:1581-1588.
Abseits der gut reproduzierbaren und kontrollierten Laborsituation stellt die klinische Variabilität eine große Herausforderung für die Vorhersagekraft präklinischer Studien dar. STROK@LLIANCE bietet eine einzigartige Strategie, mit der Sie die Leistung Ihres Wirkstoffkandidaten unter verschiedenen klinischen Bedingungen testen können.
In-situ-Infusion von heterologem Blut (Mäuse, Ratten)
Zerebrale Injektion von Kollagenase (Mäuse, Ratte)
Intrazerebrale Aneurysmen: Subarachnoidalblutungen bei Mäusen